|
|
MODULE 6 Rotation des molécules polyatomiques
Problèmes
-
La molécule 0=C=S est linéaire et les
longueurs 0=C et C=S sont respectivement égales à 0,116 et 0,156 nm.
Situez la position du centre de masse de la molécule, et calculez
son moment d'inertie dans le système SI.
Mêmes questions pour la molécule N=N=O;
les longueurs des liaisons N=N et N=O sont respectivement égales à
0,115 et 0,123 nm. Corrigé
-
Une série de raies rotationnelles de
la molécule d'hydrogène est observée en spectroscopie électronique
dans la région de l'ultraviolet sous vide (υ' ← υ :
3' ← 0) :
|
E
(cm–1)
|
|
94 058,57
|
93 410,17
|
92 010,92
|
|
94 003,30
|
93 315,81
|
91 845,79
|
|
93 908,26
|
93 030,70
|
91 370,61
|
|
93 861,08
|
92 912,75
|
91 181,89
|
|
93 702,69
|
92 564,29
|
90 643,35
|
|
93 631,92
|
92 422,74
|
89 829,15
|
Calculez B'
et B, re'
et re,
ainsi que la position de la raie  03.
Pour ce faire, indexez convenablement les raies (J
et m) et tracez
la parabole de Fortrat, en utilisant un moyen électronique approprié
pour calculer les coefficients du polynôme E = d + am + cm2 Corrigé. 03.
Pour ce faire, indexez convenablement les raies (J
et m) et tracez
la parabole de Fortrat, en utilisant un moyen électronique approprié
pour calculer les coefficients du polynôme E = d + am + cm2 Corrigé.
-
Faites de même pour la série correspondant
à la transition (4' ← 0)
:
|
E
(cm–1)
|
|
95 253,64
|
94 600,47
|
93 172,58
|
|
95 193,60
|
94 477,47
|
92 957,34
|
|
95 105,72
|
94 213,84
|
92 517,96
|
|
95 044,22
|
94 060,10
|
92 271,96
|
|
94 897,76
|
94 737,88
|
91 773,99
|
|
94 805,51
|
94 553,38
|
|
-
Les raies, exprimées en nombre d'onde,
E (cm–1),
mesurées dans le spectre électronique d'un hydrure diatomique sont
indiquées dans le tableau qui suit. Déterminez pour chaque raie, les
valeurs de J en
utilisant la méthode des différences.
|
30 005,03
|
30 094,82
|
30 127,92
|
30 148,97
|
30 203,40
|
|
30 024,67
|
30 110,25
|
30 133,81
|
30 150,65
|
30 211,25
|
|
30 043,47
|
30 113,61
|
30 138,87
|
30 174,78
|
30 218,26
|
|
30 061,43
|
30 121,18
|
30 143,08
|
30 185,16
|
30 224,43
|
|
30 078,55
|
30 124,84
|
30 146,44
|
30 194,70
|
30 229,76
|
Tracez la parabole de Fortrat et,
sur le même graphe, identifiez les branches P,
Q et R.
Calculez également les valeurs de B
et de B'
dans les états électroniques concernés. Corrigé
-
En spectroscopie électronique, une
bande d'absorption du 35Cl2 sous très haute
résolution montre une série de raies données dans le tableau suivant.
En utilisant la méthode de la deuxième différence, établissez les
valeurs de J,
m, les branches
P et R.
Tracez la parabole de Fortrat.
|
18 147,85
|
18 146,91
|
18 145,02
|
18 141,87
|
|
18 147,81
|
18 146,66
|
18 144,41
|
18 140,34
|
|
18 147,71
|
18 146,25
|
18 143,94
|
18 138,64
|
|
18 147,60
|
18 145,93
|
18 143,23
|
18 136,76
|
|
18 147,22
|
18 145,42
|
18 142,69
|
18 134,71
|
Calculez les valeurs de B
et de B' dans
les états électroniques concernés, ainsi que les distances internucléaires
correspondantes.
-
Démontrez les expressions données dans le module pour les moments
d'inertie de la molécule BrF5. Corrigé
Problèmes avec VR Molécules
-
Placez VR Molécules à la page 5.
En mesurant les distances internucléaires à l'aide de la grille, déterminez
la valeur du moment d'inertie de la molécule HCN. À partir de cette
valeur, calculez la constante de rotation B
et comparez-la avec la valeur qui peut être déduite de l'énergie de
rotation affichée par VR Molécules pour J = 10.
Corrigé
-
Placez VR Molécules à la page 6.
En mesurant les distances internucléaires à l'aide de la grille, déterminez
la valeur du moment d'inertie de la molécule C2H2.
À partir de cette valeur, calculez la constante de rotation B
et comparez-la avec la valeur qui peut être déduite de l'énergie de
rotation affichée par VR Molécules pour J = 10.
Corrigé
-
Placez VR Molécules à la page 7.
En mesurant, à l'aide de la grille, les longueurs appropriées, déterminez
la valeur des moment d'inertie
Ipar et
Iperp de la molécule SO3. À partir
de la valeur de
Iperp, calculez la constante de rotation
B
et comparez-la avec la valeur qui peut être déduite de l'énergie de
rotation affichée par VR Molécules pour J = 10.
Corrigé
Corrigés
-
La distance de l'atome de soufre au
centre de masse est calculée à l'aide de la relation suivante :
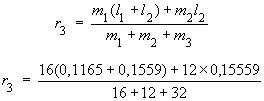
r3 = 0,1038 nm
Remarque : Point n'est besoin
de diviser les masses par le nombre d'Avogadro puisque ce même facteur
se retrouve au numérateur et au dénominateur.
Dans le cas de N=N=O, on montre, de
la même façon, que le centre de masse est pratiquement confondu avec
l'atome d'azote central.
De leur côté, les moments d'inertie
sont donnés par la relation :
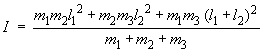
Il ne reste qu'à remplacer chaque valeur
littérale par sa valeur numérique. Pour O=C=S, on obtient :
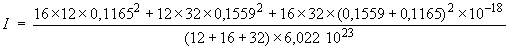
I
= 0,1382 10–41 = 1,382 10–42 m2
g
I
= 1,382 10–45 kg m2
On procède de la même manière pour
N=N=O. On obtient :
I
= 7,05 10–46 kg m2
-
La difficulté première de ce problème
réside dans la détermination des raies appartenant respectivement
à la bande pauvre et à la bande riche. Pour « démêler » les deux groupes
de raies on peut utiliser deux techniques de manière complémentaire
: la première est visuelle; la seconde, arithmétique, est appelée
la méthode de la deuxième différence.
La première méthode consiste à porter
sur un axe horizontal gradué en cm–1 la position
de chacune des raies, position représentée par un trait vertical de
1 à 2 cm de longueur (voir figure ci-dessous). Une fois ce travail
de dessin terminé, on cherchera à regrouper les raies dans deux suites
de raies, chacune révélant une progression constante dans l'espacement
inter-raie.
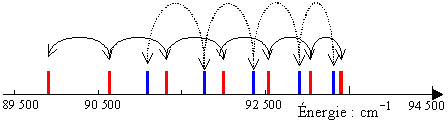
Positionnement des raies et agencement des deux groupes (riche et
pauvre).
On se rend ainsi visuellement compte
que les raies ainsi constituées :
89 829,15 – 90 643,35 – 91
370,61 – 92 010,92 …
forment une suite dont l'interespace
diminue régulièrement.
Il est alors temps d'utiliser la deuxième
différence pour constituer de manière plus rigoureuse les deux groupes
de raies. La première différence entre les deux raies tout juste indiquées
est telle que :
ΔE
= 90 643,35 – 89 829,15 = 814,20 cm–1.
La différence entre les deux raies
suivantes donne :
ΔE
= 89 829,15 – 91 370,61 = 727,26 cm–1.
La deuxième différence :
Δ[ΔE]
= 814,20 – 727,26 = 86,94 cm–1
Une propriété des courbes quadratiques
(paraboliques) réside dans le fait que la deuxième différence doit
être constante. On choisira donc les raies de telle manière que cette
propriété soit respectée dans chacune des deux branches (riche et
pauvre). On peut dès lors, de proche en proche, construire le tableau
qui suit. On porte dans la colonne médiane, les valeurs en cm–1
des raies observées. Puis, de part et d'autre de cette colonne on
calcule la première différence de chacune des branches. Enfin, dans
les deux colonnes extrêmes, on indique les deuxièmes différences.
Notez qu'à moins d'avoir fait d'abord
l'analyse graphique on doit procéder par essais et erreurs pour déterminer
s'il faut calculer les premières différences entre deux raies successives
ou à toutes les deux raies, selon que l'on se trouve en dehors ou
dans la zone commune des deux branches, zone que l'on ne connaît pas
a priori.
| Δ[Δ[E(cm–1)]] |
Δ[E(cm–1)] |
E(cm–1)
|
Δ[E(cm–1)] |
Δ[Δ[E(cm–1)]] |
| |
|
94 058,57 |
|
|
| |
55,27 |
|
|
|
| 86,95 |
|
94 003,30 |
|
|
| |
|
|
|
|
| |
142,22 |
93 908,26 |
|
|
| |
|
|
|
|
| 86,94 |
|
93 861,08 |
205,57 |
|
| |
|
|
|
|
| |
229,16 |
93 702,69 |
|
86,95 |
| |
|
|
|
|
| 86,95 |
|
93 631,92 |
292,52 |
|
| |
|
|
|
|
| |
316,11 |
93 410,17 |
|
86,95 |
| |
|
|
|
|
| 86,95 |
|
93 315,81 |
379,47 |
|
| |
|
|
|
|
| |
403,06 |
93 030,70 |
|
86,94 |
| |
|
|
|
|
| 86,95 |
|
92 912,75 |
466,41 |
|
| |
|
|
|
|
| |
490,01 |
92 564,29 |
|
86,96 |
| |
|
|
|
|
| 86,94 |
|
92 422,74 |
553,37 |
|
| |
|
|
|
|
| |
576,95 |
92 010,92 |
|
86,94 |
| |
|
|
|
|
| 86,95 |
|
91 845,79 |
640,31 |
|
| |
|
|
|
|
| |
663,90 |
91 370,61 |
|
86,95 |
| |
|
|
|
|
| |
|
91 181,89 |
727,26 |
|
| |
|
|
|
|
| |
|
90 643,35 |
|
86,94 |
| |
|
|
814,20 |
|
| |
|
89 829,15 |
|
|
| Bande riche R |
|
Bande pauvre P |
L'étape suivante consiste à identifier
laquelle des deux branches constitue la bande riche et laquelle la
bande pauvre. Dans un tel ensemble de raies, la bande qui contient
la raie la plus énergétique, ici la raie située à 94 058,57 cm–1,
est la bande riche. Il reste à identifier pour chacune des raies quelle
est sa valeur J
(le nombre quantique de rotation), puis à effectuer le changement
de variable J →
m selon les conditions déjà vues : m = –J
pour les raies pauvres et m = J + 1
pour les raies riches (voir tableau et graphes qui suivent).
Réponse du calculateur :
E(cm–1)
= 94 026,9 + 75,1523 m – 43,4737 m2
= d + am + cm2
Pour terminer le problème, il reste
à donner la signification physique de chacun des facteurs de l'équation
en m2.
L'ordonnée à l'origine, d,
représente la transition électronique pure, soit :
 03
= 94 026,9 cm–1 03
= 94 026,9 cm–1
Les valeurs de la constante rotationnelle
dans l'état électronique fondamental et dans l'état électronique excité,
B et B',
sont telles que B + B' = a
et B – B' = c.
On obtient :
B
= 59,313 cm–1 et B'
= 15,839 cm–1
Ces valeurs permettent de calculer
la longueur de la liaison dans chacun des deux états électroniques
:
re
= 0,0751 nm et re'
= 0,1453 nm
On le voit bien ici, les deux états
électroniques sont géométriquement très différents : la liaison a
presque doublé de longueur. Cela entraîne une modification importante
des constantes B
et B' de telle
sorte que la courbe monotone croissante que l'on observait en spectroscopie
vibrationnelle est toujours une parabole mais n'est plus monotone
croissante; elle atteint un maximum pour une valeur de m
donnée, pour diminuer par la suite.
-
Une première méthode basée sur l'essai
et erreur vise à rechercher et regrouper les raies de telle manière
que la seconde différence demeure constante (tableau suivant). Cette
méthode n'est pas toujours facile d'usage. Notons que dans le cas
présent le regroupement est facilité par le fait que les huit raies
les plus énergétiques ont une seconde différence approximativement
constante : Δ(ΔE) = 0,84 cm–1;
elles appartiennent à la branche R.
Il en est de même des sept raies les moins énergétiques, que l'on
peut associer à la branche P.
Les raies médianes se regroupent dans une troisième branche Q
après avoir exclu une raie qui s'incorpore à la branche P.
| m |
J |
E(cm–1) |
Δ[E(cm–1)] |
Δ[Δ[E(cm–1)]] |
Commentaires |
| –9 |
9 |
30 005,03 |
|
|
Branche P |
| |
|
|
19,64 |
|
| –8 |
8 |
30 024,67 |
|
0,84 |
| |
|
|
18,80 |
|
| –7 |
7 |
30 043,47 |
|
0,84 |
| |
|
|
17,96 |
|
| –6 |
6 |
30 061,43 |
|
0,84 |
| |
|
|
17,12 |
|
| –5 |
5 |
30 078,55 |
|
0,85 |
| |
|
|
16,27 |
|
| –4 |
4 |
30 094,82 |
|
0,84 |
| |
|
|
15,43 |
|
| –3 |
3 |
30 110,25 |
|
0,84 |
| |
|
|
14,59 |
|
| –2 |
2 |
30 124,84 |
|
|
| |
2 |
30 113,61 |
|
|
Branche Q |
| |
|
|
7,57 |
|
| 3 |
3 |
30 121,18 |
|
0,83 |
| |
|
|
6,74 |
|
| 4 |
4 |
30 127,92 |
|
0,85 |
| |
|
|
5,89 |
|
| 5 |
5 |
30 133,81 |
|
0,83 |
| |
|
|
5,06 |
|
| 6 |
6 |
30 138,87 |
|
0,85 |
| |
|
|
4,21 |
|
| 7 |
7 |
30 143,08 |
|
0,85 |
| |
|
|
3,36 |
|
| 8 |
8 |
30 146,44 |
|
0,83 |
| |
|
|
2,53 |
|
| 9 |
9 |
30 148,97 |
|
0,85 |
| |
|
|
1,68 |
|
| 10 |
10 |
30 150,65 |
|
|
| 3 |
2 |
30 174,78 |
|
|
Branche R
|
| |
|
|
10,38 |
|
| 4 |
3 |
30 185,16 |
|
0,84 |
| |
|
|
9,54 |
|
| 5 |
4 |
30 194,70 |
|
0,84 |
| |
|
|
8,70 |
|
| 6 |
5 |
30 203,40 |
|
0,85 |
| |
|
|
7,85 |
|
| 7 |
6 |
30 211,25 |
|
0,84 |
| |
|
|
7,01 |
|
| 8 |
7 |
30 218,26 |
|
0,84 |
| |
|
|
6,17 |
|
| 9 |
8 |
30 224,43 |
|
0,84 |
| |
|
|
5,33 |
|
| 10 |
9 |
30 229,76 |
|
|
L'agencement des raies à l'intérieur
de chacune des branches P,
Q et R
peut se faire d'une manière simple en portant sur un même axe gradué
en cm–1 les raies observées. La raie la plus énergétique
appartient à la bande riche, la branche R,
et celle la moins énergétique à la bande pauvre, la branche P.
Les autres sont à regrouper à l'intérieur de la branche Q
ou de l'une ou l'autre des branches P
et R. Un simple examen
visuel, à qui est un peu habitué, permet de reconnaître une suite,
une progression constante et régulière, des différences d'énergie
des 8 raies les plus énergétiques. On en calcule les différences et
les secondes différences. Cela permet de conforter les résultats obtenus
avec le tableau précédent.
Une fois les raies convenablement regroupées
dans chacune des branches P,
Q et R,
il faut leur attribuer la valeur de J.
Le premier essai est de partir avec la valeur J = 0.
Ainsi les premières raies des branches Q
et R auront la valeur
J = 0
et la première raie de la branche pauvre sera indicée J
= 1 (transition J = 1
→ J = 0).
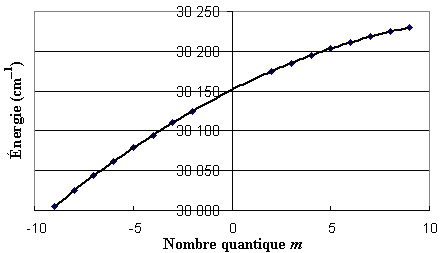
Un graphe de l'énergie des raies en fonction de m
produit une courbe discontinue à m = 0.
On doit soupçonner une erreur dans l'attribution des valeurs J
à chacune des raies.
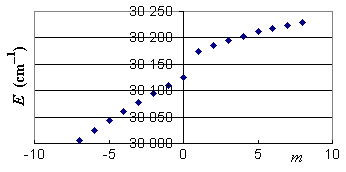
La valeur de Jmin
est 0
On peut soupçonner que la molécule
est de type toupie symétrique. Dans ce cas, les premières valeurs
de J ne sont
pas disponibles. On essaie donc la même opération en notant la première
raie avec la valeur J = 1.
Si le niveau J = 1
est disponible, on doit observer les transitions suivantes :
-
branche R :
J = 1
vers J' = 2;
avec le changement de variable m = J + 1,
m
passe de m = 2
à m' = 3;
-
branche Q :
J = 1
vers J' = 1;
avec le changement de variable m = J,
m
passe de m = 1
à m' = 1;
-
branche P :
J = 2
vers J' = 1;
avec le changement de variable m = –J,
m
passe de m = –2
à m' = –1.
Les trois segments de courbes ont les
équations analytiques suivantes :
-
branche R :
y = – 0,421 19 x2
+ 12,48714 x + 30151,49048; R2 = 1,000
00;
-
branche P :
y = – 0,421 19 x2
+ 12,482 86 x + 30151,490 48; R2 = 1,000
00;
-
branche Q :
y = –
0,421 08 x2 - 0,419 84 x + 30151,49238;
R2 = 1,000 00.
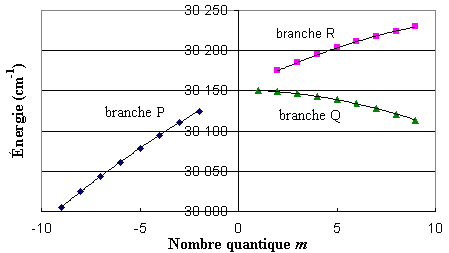
Cette fois la concordance est bien
meilleure. Les expressions analytiques des branches P
et Q sont
pratiquement semblables. En outre, l'interception des trois courbes
avec l'axe des ordonnées est identique, à 30 151,49 cm–1.
Cette dernière valeur correspond à la transition électronique pure.
Une seule courbe intégrant les données des branches P
et R a
l'expression analytique suivante :
- branches P
et R :
y = – 0,421 00 x2
+ 12,485 00 x + 30151,49 ; R2 = 1,000 00
En se rappelant que la somme B + B'
est identique au coefficient de x
et que la différence B – B'
est identique au coefficient de x2,
on obtient :
B
+ B' = 12,485 cm–1 et
B'
–B = – 0,421 cm–1
D'où :
B'
= 6,032 cm–1 et
B =
6,453 cm–1
La constante B
diminue de manière significative (environ 7 %) en passant de
l'état fondamental vers l'état électronique excité. On a donc une
modification importante de la distance internucléaire moyenne, qui
augmente d'environ 3,5 %.
-
La molécule BrF5 est constituée
d'un carré dont chacun des sommets est occupé par un atome de fluor,
et le centre par l'atome de brome. Le cinquième atome de fluor est
situé sur l'axe de symétrie d'ordre 4, en dehors de ce plan carré
(voir figure ci-dessous). Soient r1 les longueurs
des liaisons BrF dans le plan carré et r2 celle
de BrF en dehors du plan carré. Le centre de masse, G,
est nécessairement situé sur l'axe de symétrie. Soit a
la distance entre l'atome de brome et G.
On a donc :
a
+ b = r2 ou
encore b
= r2 – a
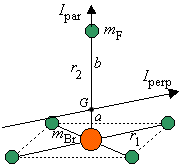
Par ailleurs, la position du centre
de masse est définie par la relation :
mF b
= mBr a + 4 mF a
En remplaçant b
par la valeur obtenue plus tôt, on obtient :
mF (r2 – a)
= mBr a + 4 mF a
ce qui se réécrit :
mF r2 – mF a = mBr a
+ 4 mF a
mF r2 = mBr a
+ 4 mF a + mF a = Σmi a
Σmi
est la somme des masses des atomes constitutifs de la molécule. Finalement,
en réarrangeant cette dernière expression, on obtient :
a = mF r2 / Σmi
La position du centre de masse est
donc complètement définie en termes de la distance et des masses des
atomes constituant la molécule.
Calculs des moments d'inertie de BrF5
Le moment d'inertie parallèle à l'axe
de symétrie, noté Ipar,
n'est dû qu'aux quatre atomes de fluor du carré; il est simplement
donné par la relation suivante :
Ipar
= 4 mF r22
Le moment d'inertie perpendiculaire
à l'axe de symétrie, noté Iperp,
est donné par la relation suivante :
Iperp = mBr a2
+ mF b2 + 2 mF a2
+ 2 mF (r12 +
a2)
Iperp = mBr a2
+ mF b2 + 2 mF a2
+ 2 mF r12 + 2
mF a2
Iperp = mBr a2
+ mF (r2 – a)2
+ 2 mF a2 + 2 mF r12
+ 2 mF a2
Iperp = mBr a2
+ mF (r22– 2ar2 + a2)
+ 2 mF a2 + 2 mF r12
+ 2 mF a2
Iperp = mBr a2
+ mF r22 – 2 mF ar2 + mF a2
+ 2 mF a2 + 2 mF r12
+ 2 mF a2
Iperp = a2 Σmi
+ 2 mF r12 + mF r22 – 2 amF r2
Il ne reste plus maintenant qu'à remplacer a
par la valeur établie plus haut :
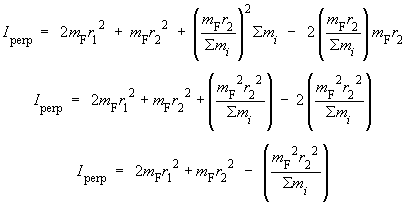
On obtient bien l'équation donnée dans le module :
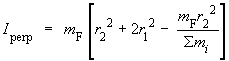
La valeur du moment d'inertie perpendiculaire
à l'axe de symétrie est donc, elle aussi, entièrement déterminée par
les données relatives à la structure et à la composition de la molécule.
Corrigés des problèmes avec VR Molécules
-
Les distances au centre de masse des
atomes N, C et H sont respectivement 61 pm, 56 pm et 163 pm.
Le moment d'inertie est donc donné
par :
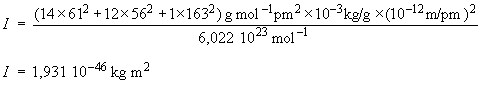
et la constante B
est donnée par :
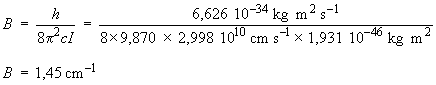
ce qui est proche de la valeur qu'on
peut déduire à partir des informations fournies dans VR Molécules. En
effet, B
est égal à la moitié de l'énergie à J = 1,
soit 1,48 cm–1.
-
Les distances au centre de masse des
atomes C et H sont respectivement 60 pm et 168 pm. De la
même façon qu'à l'exercice précédent, on trouve :
I = 2 (12 × 602 + 1 × 1682
) / 6,022 × 1050 = 2,372 × 10–46 kg m2
d'où B =
1,18 cm–1, ce qui est égal à la valeur obtenue
dans VR Molécules.
-
Le distance au centre de masse des
atomes d'oxygène est de 142 pm. Le moment d'inertie Ipar
est simplement égal à trois fois le moment d'inertie d'un atome d'oxygène
par rapport à l'axe de symétrie de la molécule, soit, en SI :
Ipar = 3 × 16 g mol–1 × 10–3 kg/g × (142 × 10–12 m)2 / 6,022 × 1023 mol–1
= 1,607 × 10–45 kg m2
De son côté, le moment Iperp
est égal à deux fois le moment d'inertie d'une molécule d'oxygène
par rapport à un axe passant par une des liaisons S-O (pointillés
dans la figure ci-dessous). On trouve :
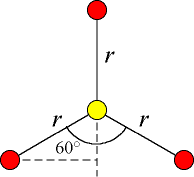
Iperp = 2 × 16 × 10–3 × (142 × 10–12 × sin 60°)2 / 6,022 × 1023 = 0,803 × 10–45 kg
m2
d'où l'on tire, de la même manière
que précédemment, B =
0,35 cm–1, ce qui est à peu près égal à la
valeur obtenue dans VR Molécules.
|



