|
|
GLOSSAIRE
A
B C
D E
F G
H I
J K
L M
N O
P Q
R S
T U
V W
X Y
Z
A
|
ABSORPTION
|
Du latin absorptio,
même sens.
PHOTOCHIMIE : atténuation relative.
[mesure de concentration sur le trajet
optique]. Processus d'interaction où des
photons incidents sont instantanément
annihilés pour porter la matière sur
un état énergétique
excité.
Selon la loi de Lambert-Beer,
le coefficient d'absorption k, pour une
fréquence optique ν donnée,
est le gradient axial relatif d'énergie du
faisceau
|
|
ADSORPTION
|
CINÉTIQUE
HÉTÉROGÈNE :
Phénomène de sorption physique
où des molécules sont sorbées
(attachées) physiquement à la surface
d’un solide (liens de Van der Walls).
|
|
ACTIVATION
|
Ce mot n'est utilisé en cinétique
que dans l'expression énergie d'activation.
Il représente la barrière
d'énergie qu'un système doit franchir
pour passer d'un état initial à un
état final plus stable.
|
|
AMORÇAGE
|
Cinétique des réactions en
chaînes : voir Initiation.
|
|
AMPÈRE, A
|
Unité de base du système SI.
C’est l’intensité d’un
courant électrique constant qui, maintenu
dans deux conducteurs parallèles,
rectilignes, de longueur infinie et de section
circulaire négligeable, et placés
à une distance de un mètre l’un
de l’autre dans le vide, produit entre ces
deux conducteurs une force de
2 × 10–7 newtons
par mètre de longueur.
|
|
ANGSTRÖM, Å
|
Unité de mesure de longueur
tolérée avec le système
SI.
|
|
ANISOTROPE
|
Se dit de propriétés variant avec
la direction de l'observation
|
|
ANTIFERROÉLECTRIQUE
|
Se dit d'un arrangement atomique favorisant
l'apparition d'un moment dipolaire permanent dans
une maille élémentaire cristalline,
avec alternance du signe de polarisation de maille
en maille.
|
|
ANTIFERROMAGNÉTISME
|
Propriété d'avoir une disposition
alternée du moment magnétique
porté par un type d'atome et ses homologues
voisins.
|
|
ARRHENIUS
|
Équation de. S'écrit d
(Log nk) / dT =
EA / RT 2
où EA désigne
l'énergie d'activation (exprimée en
J/mol), encore appelée énergie
d'activation expérimentale, apparente ou
globale. R est la constante des gaz parfaits (en
J × mol–1 × K–1).
Sous sa forme intégrée, cette
équation devient
k = Ae–Ea/RT.
A est appelé facteur
pré-exponentiel ou encore facteur de
fréquence dans le cas des réactions
de premier ordre.
Diagramme de. Graphe de Log (k) en
fonction de 1/T.
|
|
ATMOSPHÈRE,
atm
|
Unité de mesure de pression
tolérée avec le système
SI.
|
|
ATTO, a
|
Sous-multiple valant 10–18.
|
|
AUTO-INFLAMMATION
|
Angl. self-ignition. L'auto-inflammation
est une inflammation dans laquelle un
mélange combustible-comburant porté
à une température et une pression
suffisantes s'enflamme "spontanément" dans
certaines conditions de confinement, dans des
moteurs, par exemples.
|
|
AUTO-INHIBITION
|
Inhibition d'une réaction par un
composé inhibiteur produit par la
réaction elle-même.
|
[ début
]
B
|
BALMER,
série de
|
Série de raies (visible) émises
par l'atome d'hydrogène excité,
l'électron allant d'une orbitale externe
vers le niveau n = 2.
|
|
BAR, bar
|
Unité de mesure de pression
tolérée avec le système
SI.
|
|
BARRIÈRE
D'ACTIVATION
|
Voir
Énergie d’activation
|
|
BARYE
|
Unité de mesure de pression dans le
système d’unités C.G.S.
|
|
BCS
|
Abréviation de Bardeen, Cooper et
Schrieffer, auteurs de la théorie sur la
supraconductivité en 1957.
|
|
BÉCKEREL, Bq
|
Unité SI de mesure en radiologie.
C’est l’activité d’un noyau
qui subit une désintégration par
seconde.
|
|
BEER, loi de
|
Voir Lambert-beer
(loi de).
|
|
BIMOLÉCULAIRE,
réaction
|
Réaction qui implique deux
molécules.
|
|
BOHR
|
Rayon de. Rayon de l'orbite sphérique de
l'électron de la couche 1s de l'atome
d'hydrogène.
Magnéton de. Moment magnétique
unitaire en mécanique quantique, valant μB = 9,274 × 10–24 ·A · m2
|
|
BOLTZMANN, constante
de
|
k = 1,380 662 × 10–23
J/K
|
|
BOYLE, loi de
|
La pression d'un gaz est inversement
proportionnelle au volume de ce gaz à
température constante.
|
|
BRAGG, loi de
|
Loi reliant l'angle de réfraction, θ,
d'un faisceau de lumière, d'électrons
sur un réseau atomique et la longueur
d'onde, λ, du faisceau : nλ = 2d sin θ.
|
|
BRANCHEMENT
|
Voir Ramification (d’une
réaction en chaîne).
|
[ début
]
C
|
CALOPORTEUR
|
Angl. coolant. Fluide caloporteur. Se dit
d'un fluide transportant de l'énergie
thermique d'un système à un
autre.
|
|
CALORIE, cal
|
Du latin calor : chaleur. Unité
d'énergie sous forme thermique (symbole
cal). La calorie est la quantité de chaleur
nécessaire pour élever de
1 ºC la température de 1 g
d'un corps dont la chaleur massique est
égale à celle de l'eau à
15 ºC sous la pression
atmosphérique normale.
L'utilisation de cette unité est
prohibée au Canada. L'unité
d'énergie du système SI est le joule
(symbole J); 1 cal = 4,1855 J.
|
|
CANDELA, cd
|
Unité de base du système SI.
C’est l’intensité lumineuse, dans
la direction perpendiculaire, d’une surface de
1/600 000 m2 d’un corps noir
à la température de
congélation du platine sous la pression de
101 325 Pa.
|
|
CARBURANT
|
Angl. fuel. Un carburant est un
combustible destiné à l'alimentation
d'une machine thermique, qu'il soit ou non
carboné.
|
|
CATALYSE
|
Angl. catalysis.
Accélération ou modification d'une
réaction chimique sous l'effet d'une
espèce chimique, le catalyseur, pouvant agir
en dose infime et qui se retrouve
inaltérée en fin de la
réaction.
|
|
CATALYSEUR
|
Composé qui, introduit en petite
quantité avec les réactifs,
accélère fortement la vitesse
d’une réaction chimique et se retrouve
pratiquement inchangé en fin de
réaction.
|
|
CELSIUS,
échelle
|
Échelle linéaire de
température définie par
T = 0 ºC pour la
température de solidification de l’eau
pure et T = 100 ºC la
température d’ébullition de
l’eau pure.
|
|
CELSIUS,
température
|
Voir Celsius
(échelle)
|
|
CENTI, c
|
Sous-multiple valant 0,01 ou 1/100.
|
|
CHAÎNE
|
CHIMIE ORGANIQUE : chaîne
hydrocarbonée ou squelette
hydrocarboné.
CINÉTIQUE : voir Longueur
de chaîne. C’est le rapport du
nombre de fois que se reproduit une boucle de
réactions chimiques sur le nombre de
réactions d’amorçage ou
d’initiation.
|
|
CHAMBRE À
BULLES
|
Appareil qui permet la détection des
trajectoires des particules qui la traverse. Ces
particules créent dans la chambre une
traînée de "bulles", d'où son
nom.
|
|
CHARBON ACTIF
|
Un charbon actif est un matériau
carboné poreux qui a été
activé afin d'accroître sa
porosité. Les charbons actifs ont une grande
capacité d'adsorption et sont
utilisés pour la purification de liquides et
de gaz.
|
|
CHARGE
ÉLECTRIQUE ÉLÉMENTAIRE
|
Charge, égale en valeur absolue à
celle de l'électron ou du proton, la plus
petite pouvant être isolée; sa
grandeur est
e = 1,602 192 × 10–19
C.
|
|
CHARLES, loi de
|
Le volume d'un gaz est directement proportionnel
à la température de ce gaz sous
pression constante.
|
|
CHEMIN
RÉACTIONNEL
|
Dans un processus élémentaire,
ensemble des différentes positions des
atomes lors du passage effectif des réactifs
aux produits. Il correspond au chemin
nécessitant le minimum d'énergie pour
passer des réactifs aux produits.
Dans une réaction globale, ensemble des
différentes réactions
élémentaires nécessaires au
passage effectif des réactifs aux produits.
Il correspond au chemin nécessitant le
minimum d'énergie pour passer des
réactifs aux produits.
|
|
CHIMILUMINESCENCE
|
Angl. chemiluminescence. Processus
d'émission lumineuse dû à la
relaxation radiative spontanée
d'espèces chimiquement créées
sur des états excités.
|
|
CHIMIIONISATION
|
Angl. chemi-ionization. Réaction chimique
dont l'un des produits est un ion.
|
|
CLAUSIUS-CLAPEYRON,
loi de
|
Loi qui exprime la variation de pression en
fonction de la température lors d'une
transition de phase :
dp/dT = H / TV.
|
|
CLIQUETIS
|
Voir COGNEMENT.
|
|
COEFFICIENT
DE DIFFUSION
|
PHOTOCHIMIE : Angl. scattering
coefficient. Coefficient caractérisant
les propriétés de diffusion d'un
nuage de particules (poussières,
molécules,…) et donnant le taux de
diffusion du flux lumineux par unité de
longueur.
CINÉTIQUE EN PHASE LIQUIDE :
|
|
COEFFICIENT
D'EXTINCTION
|
PHOTOCHIMIE : Angl. extinction
coefficient. Coefficient caractérisant
les propriétés d'absorption d’un
matériau et donnant le taux d'absorption et
de diffusion par unité de longueur.
|
|
COGNEMENT
|
Angl. knock. On dit qu'il y a cognement
lorsque le bruit anormal de combustion émis
par un moteur à quatre temps. Le bruit de
combustion résulte de l'auto-inflammation du
combustible après son injection dans la
chambre de combustion avant l’apparition de
l’étincelle produite par la bougie
d’allumage. Celle-ci a lieu au bout d'un temps
appelé délai d'auto-inflammation. Le
cognement engendre une diminution de la puissance
disponible. L'usage d'un carburant ayant un indice
d’octane suffisamment élevé
permet de prévenir le cognement.
|
|
COLLISION
|
Les collisions sont des chocs qui impliquent des
atomes, des radicaux ou des molécules dans
toutes les combinaisons possibles deux à
deux.
|
|
COMBUSTIBLE
|
Angl. fuel (nom), combustible
(adjectif). Espèce chimique
généralement constituée
d'atomes faiblement électronégatifs,
ou dans laquelle ces atomes prédominent, et
qui est susceptible de donner lieu à une
combustion en réagissant avec un
comburant.
|
|
COMPLEXE
ACTIVÉ
|
Configuration critique que doit atteindre le
complexe transitoirement formé lors de la
collision pour que cette dernière soit
réactive.
|
|
CONSERVATION, loi
de
|
Énoncé que dans certaines
conditions, une quantité demeure
inchangée dans le temps et (ou) à la
suite des modifications subies par un objet ou un
système. En mécanique, on retrouve
les lois de conservation :
- de l'énergie;
- de la masse (et éventuellement du
couple énergie-masse);
- de la quantité de mouvement;
- du moment cinétique (ou
angulaire).
|
|
CONSTANTE DE
VITESSE
|
La constante de proportionnalité k
apparaissant dans l’équation de vitesse
de réaction
(V = k [A]a [B]b…)
s'appelle constante de vitesse (ou encore vitesse
spécifique). Elle dépend de la
température du système
réactionnel.
|
|
CONSTANTE
DES GAZ PARFAITS
|
R = 8,314 41 J / (mol · K)
|
|
COORDONNÉE
DE RÉACTION
|
Si, dans une réaction
élémentaire, un seul paramètre
définit le chemin réactionnel, on
l'appelle coordonnée de réaction.
|
|
CORPS NOIR
|
Un parfait radiateur (et absorbeur)
d'énergie.
|
|
COULOMB, C
|
Unité de charge électrique du
Système SI. C’est la quantité
d’électricité transportée
en 1 s par un courant de 1 A.
|
|
COURBE
D'ÉNERGIE POTENTIELLE
|
Courbe représentant, pour une
réaction élémentaire,
l'énergie potentielle en fonction de la
coordonnée de réaction.
|
|
CURIE
|
Constante de. Caractéristique d'un
matériel qui indique la
proportionnalité entre la
susceptibilité magnétique de ce
matériel et sa température en
degrés kelvin. Loi de. Variation de la
suceptibilté χ d'une substance
paramagnétique en fonction de la
température : χ =
C / T.
|
|
CURIE-WEISS, loi de
|
Une loi plus générale que celle de
Curie : χ = C / (T – W).
|
[ début
]
D
|
DAVISSON et
GERMER, expérience de
|
Expérience de diffraction d'un faisceau
d'électrons sur une surface
métallique démontrant la nature
ondulatoire de ce faisceau.
|
|
DEBYE
|
Unité qui représente le moment
dipolaire d’une charge de 10–10
unités électrostatiques
(système C.G.S.) séparée
d’une charge identique mais de signe contraire
d’une distance de 10–10
m; 1 debye vaut
3,335 640 × 10–30 coulomb-mètre
(en SI).
|
|
DÉCA, da
|
Multiple valant 10.
|
|
DÉCI, d
|
Sous-multiple valant 0,1 ou 1/10.
|
|
DÉFLAGRATION
|
Angl. deflagration. Mode de propagation
autonome subsonique de la réaction dans un
milieu combustible grâce à son
couplage avec les mécanismes de transport de
chaleur et de matière.
|
|
DEGRÉ
D'AVANCEMENT
|
C’est le rapport entre le nombre de
molécules qui ont disparues
(réactifs) ou qui sont apparues (produits)
au cours d’une réaction et le
coefficient stœchiométrique de ces
molécules. Le rapport est affecté du
signe négatif lorsqu’il concerne les
réactifs.
|
|
DEGRÉ
CELSIUS, °C
|
Voir Celsius
(échelle)
|
|
DEGRÉ KELVIN,
K
|
Voir Kelvin
(échelle)
|
|
DÉTONATION
|
Du latin tonare : tonner. Angl.
detonation. Propagation d'une zone de
combustion couplée à un complexe
d'ondes de choc qui la précède, se
faisant avec une vitesse supérieure à
la célérité du son par rapport
au milieu réactif.
|
|
DIAMAGNÉTISME
|
Propriété générale
du matériau de posséder une
susceptibilité magnétique
négative ou nulle. Ces corps ont la
propriété de fuir tout champ
magnétique extérieur.
|
|
DIÉLECTRIQUE
|
Substance isolante capable d'emmagasiner de
l'énergie électrostatique. On utilise
de tels corps pour fabriquer les condensateurs.
|
|
DIFFUSION
|
DE LA LUMIÈRE : Terme
général pour décrire la
réémission de la lumière par
la matière soumise à un
rayonnement.
DE LA MATIÈRE : Dispersion dans un
milieu quelconque d’un matériel sous
l’influence du mouvement brownien.
DES RAYONS X : Réflexion
sélective des rayons X sur les plans
réticulaires d'un cristal. Cette
méthode permet d'identifier un arrangement
cristallin, sa symétrie, ainsi que les
distances inter atomiques.
INÉLASTIQUE DES NEUTRONS : La
trajectoire des neutrons est modifiée, ainsi
que leur énergie par la vibration des atomes
du cristal.
RAMAN : Diffusion d'un rayonnement dont les
fréquences optiques sont spectralement
décalées par rapport à celle
du rayonnement incident. Les décalages
spectraux sont égaux aux fréquences
de vibration, de rotation caractéristiques
des molécules diffusantes.
RAYLEIGH : Diffusion élastique
(c'est-à-dire sans absorption) de la
lumière, dans le cas où le
diamètre des particules diffusantes (telles
que des molécules) est inférieur
à la longueur d'onde du rayonnement
|
|
DIRAC, constante de
|
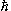 = h/2π,
où h est la constante
de Planck. = h/2π,
où h est la constante
de Planck.
|
|
DOMAINE
D'INFLAMMATION
|
Ensemble des valeurs des variables
(températures, pressions et compositions
limites) du système combustible-comburant
qui déterminent ses conditions
d'inflammation.
|
|
DULONG et PETIT,
loi de
|
La capacité calorifique molaire d'un
solide monoatomique est égale à
3 R
|
|
DURÉE DE
VIE
|
Temps de vie de molécules excitées
qui retournent normalement vers l’état
fondamental en perdant leur excès
d’énergie sous la forme de rayonnement
lumineux
|
|
DYNE
|
Unité de force dans le système
d’unités C.G.S.
|
[ début
]
E
|
EFFET COMPTON
|
Effet qui résulte de la collision entre
un photon et une particule et qui montre l'aspect
corpusculaire de la lumière
|
|
EFFET DE PAROI
|
Inhibition exercée par les parois d'un
réacteur sur le développement d'une
réaction en chaîne. L'action
inhibitrice des parois est attribuée
à l'intervention de processus
hétérogènes de rupture de
chaînes, suite à l'adsorption aux
parois de radicaux libres se transformant
ultérieurement en produits
moléculaires.
|
|
EFFET DE SERRE
|
Du latin serrare : fermer avec une barre.
Phénomène de réchauffement
lié à la rétention du
rayonnement normalement perdu vers l’espace
par des molécules absorbant ce
rayonnement.
|
|
EFFET
PHOTOÉLECTRIQUE
|
Effet montrant l'aspect corpusculaire de la
lumière.
|
|
EFFET TUNNEL
|
Passage d'une particule à travers une
barrière de potentiel.
|
|
EFFET ZEEMAN
|
Phénomène de dédoublement
de raies d’émission, d’un atome
par exemple, lorsque ce dernier est immergé
dans un champ magnétique.
|
|
ÉLECTRON, masse de
l'
|
Masse de l'électron au repos :
me = 9,109 534 × 10–31 kg.
|
|
ÉLECTRON-VOLT,
eV
|
Unité de mesure d’énergie
tolérée avec le système SI.
C'est l'énergie d'un électron
accéléré sous une
différence de potentiel de 1 V;
1 eV = 1,602 189 × 10–19 J.
|
|
ÉLECTRONÉGATIVITÉ
|
Selon Pauling, c'est la capacité
qu'à un atome au sein d'une molécule
d'attirer un électron pour lui-même.
Mulliken, pour sa part définit
l'électronégativité comme
étant un propriété atomique
qui est égale à la moyenne entre son
énergie d'ionisation et et son
affinité électronique.
|
|
ÉNERGIE
D'ACTIVATION
|
Énergie que doit avoir une
molécule, un complexe activé, …
pour pouvoir évoluer vers la formation de
produits différents de ceux qui lui ont
donné naissance.
|
|
ÉNERGIE
DE LIAISON
|
Énergie minimum qu’il faut fournir
à une molécule pour briser la liaison
considérée.
|
|
ÉNERGIE
LIBRE
|
DE HELMOLTZ : appelée parfois
énergie libre, est définie par la
relation
F = U – TS,
dont l'expression différentielle est
dF = – PdV – SdT
(T est la température, P la
pression, V le volume et S
l'entropie).
DE GIBBS : appelée parfois enthalpie
libre, est définie par la relation
G = H – TS,
où H est l'enthalpie et S
l’entropie.
|
|
ÉNERGIE
POTENTIELLE
|
Forme d'énergie reliée à la
position d'un objet dans un champ de force ou
à la configuration d'un système. Par
exemple. on parlera de l'énergie potentielle
d'un objet placé à une altitude
particulière ou encore de celle d'une
distribution donnée de charges
électriques. De la même
manière, la position d'une molécule
sur un point élevé de la surface de
potentiel (ou de la courbe de potentiel) lui
confère une énergie potentielle
particulière.
|
|
ENTHALPIE
|
L'enthalpie est une fonction d'état
(c'est à dire qui s'exprime en fonction des
variables macroscopiques caractérisant un
état d'équilibre d'un système
thermodynamique) définie par la relation
H = U + PV,
où U est l'énergie interne
d'un système soumis à un milieu
extérieur à pression P et
V le volume.
|
|
ENTROPIE
|
L'entropie S est définie par le
rapport dS = dQ/T,
dQ est la chaleur transférée
au milieu extérieur.
|
|
ÉQUILIBRE
CHIMIQUE
|
État d’une réaction chimique
atteint lorsque la variation d’énergie
libre du système est égale à
zéro.
|
|
ERG
|
Unité d’énergie dans le
système d’unités C.G.S.
|
|
ESPÈCE
EXCITÉE
|
Individu chimique (molécule, atome,
…) qui dispose d’une énergie
interne supérieure à
l’énergie thermiquement disponible.
|
|
ESPÈCE
CHARGÉE
|
Entité chimique (atome, molécule)
qui porte une (des) charge(s)
électrique(s).
|
|
ÉTAPE
DÉTERMINANTE
|
Dans un mécanisme global, étape
réactionnel qui joue un rôle
déterminant. Le plus souvent cette
réaction (la plus lente du système)
impose sa vitesse à l’ensemble du
système réactionnel.
|
|
ÉTAT
QUASI-STATIONNAIRE
|
Angl. steady-state. L'approximation de
l'état quasi-stationnaire de concentration,
proposée s'applique aux espèces
intermédiaires à courte durée
de vie (radicaux libres en particulier, très
réactifs et dont la concentration dans le
milieu reste très faible, à cause de
cette grande réactivité), pour
lesquelles on écrit que les concentrations
ne varient pas de manière sensible
après une certaine période
d'induction, et que par conséquent les
vitesses de formation et de disparition sont
égales.
|
|
ÉVAPORATION
|
Passage d’un composé de
l’état liquide à
l’état gazeux.
|
|
EXOSPHÈRE
|
Région de l'atmosphère terrestre,
au-dessus de 500 km d'altitude.
|
[ début
]
F
|
FACTEUR DE
FRÉQUENCE
|
Équivalent au facteur
préexponentiel dans les réactions
d’ordre 1.
|
|
FACTEUR
PRÉEXPONENTIEL
|
Dans la forme intégrée de
l'équation
d'Arrhénius,
k = Ae–Ea/RT,
A est appelé facteur
pré-exponentiel.
|
|
FACTEUR
STÉRIQUE
|
Du grec stéréos : solide.
Relatif à l’encombrement spatial.
|
|
FAISCEAU
MOLÉCULAIRE
|
Jet de molécules ou d’atomes plus ou
moins parallèle issu d’un
réacteur en relative surpression et passant
à travers un orifice très petit.
|
|
FARAD, F
|
Unité de capacité
électrique du Système SI. C’est
la capacité d’un condensateur
électrique entre les armatures duquel
apparaît une différence de potentiel
de 1 V, lorsqu’il est chargé
d’une quantité
d’électricité de 1 C.
|
|
FARADAY, constante de
|
F = 9,648
670 × 104 C/mol.
|
|
FEMTO, f
|
Sous-multiple valant 10–15.
|
|
FLAMME
|
Angl. flame. Région de
l’espace où s'effectue la combustion
vive, continue avec concentration importante de
radicaux dont une fraction excitée peut
émettre un rayonnement
(chimiluminescence).
|
|
FLAMME FROIDE
|
Auto-combustion spontanée, de courte
durée, largement incomplète d’un
mélange comburant-combustible. On peut dire
d’une flamme froide qu’est est une
auto-inflammation avortée
|
|
FLUORESCENCE
|
Contraction de fluor et luminescence. Angl.
fluorescence. Processus d'émission
lumineuse (UV-visible) lors de la relaxation
radiative (sans changement de multiplicité
entre le niveau électronique excité
et un niveau électronique de plus basse
énergie) spontanée d'une
espèce excitée par absorption d'un
rayonnement incident.
|
|
FUMÉE
|
Du latin fumare : fumer. Angl.
smoke. Ensemble visible des particules
solides et liquides en suspension dans les gaz
résultant d'une combustion ou d'une
pyrolyse.
|
[ début
]
G
|
GAZ IDÉAL
|
Gaz obéissant à la loi
PV = nRT. Loi de. Voir
Boyle (loi de) et Charles
(loi de).
|
|
GIBBS
|
Voir Énergie
libre.
|
|
GIGA, G
|
Multiple valant 109 ou un
milliard.
|
|
GRAY, Gy
|
Unité SI de mesure en radiologie.
C’est la dose de rayonnement d’une
énergie de 1 J absorbée dans un
kg de matière.
|
[ début
]
H
|
HECTO, h
|
Multiple valant 102 ou cent.
|
|
HEISENBERG,
principe d'
|
Voir Incertitude
(principe de).
|
|
HELMHOLTZ
|
Voir Énergie
libre.
|
|
HENRY, H
|
Unité d’inductance du système
SI. C’est l’inductance électrique
d’un circuit fermé dans lequel une
force électromotrice de 1 V est produite,
lorsque le courant électrique qui parcourt
le circuit varie uniformément à
raison de 1 A/s.
|
|
HERTZ, Hz
|
Unité de fréquence du
Système SI. Le hertz est la fréquence
d’un phénomène périodique
dont la période est une seconde.
|
|
HOOKE, loi de
|
Appliquée par exemple à un
ressort, cette loi stipule que si ce ressort est
déplacé dans un état hors de
celui de son équilibre (par compression ou
étirement), la force qui tend à le
ramener à sa position d'équilibre est
proportionnelle au déplacement qu'il a
subi.
|
|
HYPERFRÉQUENCES
|
Région du spectre
électromagnétique correspondant
à des longueurs d'onde situées entre
0,2 et 2 mm.
|
[ début
]
I
|
INCERTITUDE,
principe d'
|
Principe qui établit que l'on ne peut en
même temps connaître avec
précision la localisation spatiale d'une
molécule et sa quantité de mouvement
: Δx Δp > h/4π.
|
|
INDICE
D'OCTANE
|
Angl. octane number. L'indice d'octane
sert à apprécier la qualité de
résistance au cognement, cliquetis d'une
essence.
|
|
INFRAROUGE
|
Région du spectre
électromagnétique
caractérisée par une longueur d'onde
supérieure à 800 nm et
caractérisrique des transitions
vibrationnelles.
L'infrarouge lointain correspond à des
longueurs d'onde supérieures à
30 μm et est
caractéristique des niveaux
rotationnels d'une molécule.
|
|
INHIBITEUR
|
Du latin inhibere : retenir,
arrêter. Angl. inhibitor. Substance
ralentissant ou empêchant le
déroulement d'une réaction
chimique
|
|
INHIBITION
|
Réduction temporaire ou permanente de la
vitesse d'une réaction chimique.
|
|
INITIATION
|
Du latin initiare : commencer. Angl.
initiation. Processus
élémentaire assurant la
création initiale des centres actifs dans
une réaction en chaîne.
|
|
IONISATION
|
Angl. ionization. Processus conduisant
à la formation d’ions.
|
|
IONOSPHÈRE
|
Région de l'atmosphère terrestre,
située vers 160 km d'altitude, et
particulèrement riche en ions.
|
|
ISOTOPE
|
Deux noyaux atomiques ayant le même nombre
de protons et un nombre différents de
neutrons.
|
|
ISOTROPE
|
Se dit de propriétés invariantes
avec la direction d’observation.
|
[ début
]
J
|
JOULE, J
|
Unité d’énergie du
système SI. C’est le travail produit
par une force de 1 N dont le point
d’application se déplace de 1 m
dans la direction de la force.
|
[ début
]
K
|
KELVIN, K
|
Unité de température de base du
système SI. C’est la fraction 1/273,16
de la température du point triple de
l’eau. Voir aussi échelle
KELVIN.
|
|
KELVIN,
échelle
|
Un degré Kelvin est la graduation
élémentaire de mesure de la
température. Échelle Kelvin et
échelle Celsius sont liées par une
relation de translation :
T (°C) = T (K) + 273,16.
|
|
KILO, k
|
Multiple valant 103 ou 1 000. Ne
pas confondre avec le degré Kelvin (K), une
unité de température.
|
|
KILOGRAMME, kg
|
Unité de base du système SI.
C’est la masse du prototype en platine
irridié, qui a été
sanctionné par la Conférence
générale des poids et mesures, tenue
à Paris en 1989, et qui est
déposé au pavillon de Breteuil,
à Sèvres.
|
[ début
]
L
|
LAMBERT-BEER, loi de
|
Dans un milieu homogène,
l’intensité du faisceau
décroît exponentiellement avec la
distance x de propagation :
I = I0 e–kx
(k est une constante).
|
|
LAPLACIEN
|
Opérateur mathématique
symbolisé par ∇2 ou Δ
et équivalent à la somme des
dérivées secondes :
∇2 = Δ = ∂2/∂x2
+ ∂2/∂y2 +
∂2/∂z2.
|
|
LE CHATELIER,
loi de
|
Loi qui prévoit que, si l'on modifie les
conditions imposées à un
système initialement en équilibre
stable, ce dernier évolue dans le sens qui
tend à le ramener dans son état
initial.
|
|
LITRE
|
Unité de mesure de volume
tolérée avec le système
SI.
|
|
LONGUEUR DE
CHAINE
|
Nombre de fois que se réalise la boucle
de formation de produits divisés par le
nombre de périodes d’amorçage.
C’est aussi le nombre de porteurs de
chaîne formés par centre
d’amorçage.
|
|
LUMEN, lm
|
Unité de flux lumineux du système
SI. C’est le flux lumineux émis, dans
l’angle solide de 1 sr, par une source
ponctuelle uniforme placée au sommet de
l’angle solide et ayant une intensité
lumineuse de 1 cd.
|
|
LUX, lx
|
Unité d’éclairement lumineux
du système SI. C’est
l’éclairement d’une surface qui
reçoit normalement, d’une
manière uniformément répartie,
un flux lumineux de 1 lm/m2.
|
|
LYMAN, série
de
|
Série de raies (U.V.) émises par
l'atome d'hydrogène excité,
l'électron allant d'une orbitale externe
vers le niveau n = 1.
|
[ début
]
M
|
MAGNÉTON
NUCLÉAIRE
|
μN = 6,022
045 × 10–27 A
· m2.
|
|
MASSE RÉDUITE
|
La notion de masse réduite d'une
molécule permet de traiter un système
de n masses (comme celles constitutives des atomes
d'une molécule) en une seule masse
ponctuelle. Ainsi, les deux atomes d'une
molécule diatomique peuvent être
remplacés par une masse unique. Cette
transformation est particulièrement utile
dans des problèmes de mécaniques.
|
|
MÉCANISME
RÉACTIONNEL
|
Angl. reaction mechanism. En cinétique
chimique, le mécanisme s'apparente à
un modèle, c'est-à-dire à un
ensemble d'équations chimiques sensé
représenter le phénomène
chimique dans son ensemble.
|
|
MÉGA, M
|
Multiple valant 106 ou un
million.
|
|
MÈTRE, m
|
Unité de base du système SI.
C’est la longueur du trajet parcouru dans le
vide par la lumière pendant une durée
de 1/299 792 458 seconde.
|
|
MICRON, μ
|
Sous-multiple valant 10–6.
|
|
MILLI, m
|
Sous-multiple valant 10–3 ou
0,001.
|
|
MILLIKAN, expérience
de
|
Encore appelée "expérience de la
goutte d'huile", elle a permis d'établir la
charge électrique
élémentaire.
|
|
MOLE, mol
|
Unité de base du système SI.
C’est la quantité de matière
d’un système contenant autant
d’entités élémentaires
qu’il y a d’atomes dans 0,012 kg de
carbone 12.
|
|
MOLÉCULARITÉ
|
Nombre d'entités moléculaires
réactionnelles impliquées dans l'acte
chimique correspondant à une réaction
élémentaire.
|
|
MOMENT D'INERTIE
|
Le moment d'inertie d'une molécule par
rapport à un axe est égal à la
somme des produits de la masse de chaque atome
constituant la molécule par le carré
de la distance de cet atome à l'axe :
I = Σ miri2.
|
|
MOMENT DIPOLAIRE
|
Lorsque deux charges électriques
+q et –q sont
séparées d'une distance r, le
moment dipolaire est un vecteur de grandeur
égale à qr , situé sur
la droite reliant les charges et orienté de
la charge négative vers la charge positive.
Pour une distribution de charge, on a
P = Σ
qi ri2.
Un moment dipolaire non nul correspond à une
distribution non symétrique des charges
positives et négatives. On distingue le
moment dipolaire permanent, toujours
présent, et le moment dipolaire
induit, qui apparaît lorsqu'une
distribution de charge se déforme sous
l'effet d'un champ électrique externe. Pour
une molécule, la valeur ce ce dernier
dépend de la valeur du champ
électrique et d'une caractéristique
de la molécule appelée polarisabilité.
|
|
MONOMOLÉCULAIRE
|
Voir Réaction
monomoléculaire.
|
|
MOUVEMENT
BROWNIEN
|
Déplacement aléatoire de
particules microscopiques, moléculaires ou
atomiques en suspension dans un fluide entretenu
par la disponibilité d'énergie.
|
[ début
]
N
|
NANO, n
|
Sous-multiple valant 10–9.
|
|
NEWTON, N
|
Unité de force du système SI.
C’est la force qui communique à un
corps ayant une masse de 1 kg une
accélération de
1 m/s2.
|
|
NOIR DE
CARBONE
|
Angl. carbon black. Le noir de carbone,
est un matériau carboné
colloïdal fabriqué industriellement,
qui se présente sous forme de sphères
et d'agrégats de ces sphères et dont
les dimensions sont généralement
inférieures à 10 à
1000 nm.
|
|
NOMBRE D'AVOGADRO
|
N = 6,022 045 × 1023
mol–1.
|
|
NOMBRE D'ONDES
|
Angl. wave number. Unité
d'énergie, non rationnelle, utilisée
en spectroscopie et s'exprimant en cm–1.
L'énergie s'exprime en nombre d'ondes en
prenant l'inverse de la longueur d'onde,
elle-même exprimée en cm,
associée à cette énergie selon
l'équation de
Planck :  = 1/λ = E / hc = E
(joules)
× 5,03 × 1023. = 1/λ = E / hc = E
(joules)
× 5,03 × 1023.
|
[ début
]
O
|
OHM, ω
|
Unité de résistance
électrique du système SI. C’est
la résistance électrique qui existe
entre deux points d’un fil conducteur
lorsqu’une différence de potentiel
constante de 1 V, appliquée entre ce
deux points, produit dans ce conducteur, un courant
de 1 A, ledit conducteur n’étant
le siège d’aucune force
électromotrice.
|
[ début
]
P
|
PASCAL, Pa
|
Unité de pression du système SI.
C’est la pression ou la contrainte uniforme
qui, agissant sur une surface plane de 1
m2 exerce perpendiculairement à
cette surface, une force de 1 N.
|
|
PASCHEN,
série de
|
Série de raies (infrarouge) émises
par l'atome d'hydrogène excité,
l'électron allant d'une orbitale externe
vers le niveau n = 3.
|
|
PAULI, principe
d'exclusion
|
Dans un atome, deux électrons ne peuvent
avoir les mêmes nombres quantiques.
|
|
PEROVSKITE
|
Structure cristalline ternaire.
|
|
PHOSPHORESCENCE
|
Sorte de luminescence caractérisée
par l’émission d’une radiation
pendant des temps supérieurs à
10–5 s et jusqu’à
plusieurs minutes, voire quelques heures. Elle
correspond à des transitions
électroniques commandant un changement de
multiplicité de l’émetteur, donc
normalement interdites.
|
|
PICO, p
|
Sous-multiple valant 10–12.
|
|
PLANCK
|
Constante de. h = 6,626
176 × 10–34 J
· s.
Équation de. Relation entre l'énergie
E et la fréquence ν de la
lumière : E = hν.
|
|
POISE, p
|
Unité de mesure de viscosité
dynamique dans le système
d’unités C.G.S. Le poise vaut
0,1 Pa · s.
|
|
POLARISABILITÉ
|
Tendance de la distribution de charge d'une
molécule ou d'un atome (nuage
électronique) à se déformer
sous l'effet d'un champ électrique, faisant
ainsi apparaître un moment
dipolaire induit. On peut écrire
mathématiquement, en première
approximation, p = γE,
où E est le champ électrique,
p le moment dipolaire induit et γ
la polarisabilité.
|
|
PORTEUR DE
CHAÎNE
|
Dans un mécanisme en chaîne,
espèce généralement
radicalaire qui en réagissant provoque la
formation d’un autre radical qui a son tour
régénère le
précédent.
|
[ début
]
Q
|
QUANTUM
|
Plur. quanta. Quantité
élémentaire de matière, de
lumière.
|
[ début
]
R
|
RADIAN
|
Unité supplémentaire du
système SI. C’est l’angle plan
compris entre deux rayons qui, sur la
circonférence d’un cercle, interceptent
un arc de longueur égale à celle du
rayon
|
|
RADICAL LIBRE
|
Angl. free radical. Espèce
chimique possédant un ou plusieurs
électrons non appariés.
|
|
RAMIFICATION
|
Angl. branching. Processus chimique
particulier à certaines réactions en
chaînes qui consiste en une réaction
formant plusieurs centres actifs (atomes ou
radicaux libres) à partir d'un seul.
|
|
RÉACTIF
|
Angl. reactant. Espèce chimique
subissant une réaction chimique.
|
|
RÉACTION
BIMOLÉCULAIRE
|
Angl. bimolecular reaction. Réaction
élémentaire mettant en jeu deux
espèces initiales identiques ou
différentes.
|
|
RÉACTION
CHIMIQUE
|
Angl. chemical reaction. Cette notion
correspond à la notion de base de la chimie
et traduit à la fois la transformation de la
matière et la conservation des
espèces.
|
|
RÉACTION
DE COMBINAISON
|
Se dit de la réaction d’appariement
de deux spins électronique supportés
chacun par un radical.
|
|
RÉACTION
DE DISMUTATION
|
Angl. disproportionation reaction. Se dit
de la réaction de transfert d’un atome
d’hydrogène entre deux radicaux libres
hydrocarbonés.
|
|
RÉACTION
DÉTERMINANTE
|
Voir Étape
déterminante.
|
|
RÉACTION
DIRECTE
|
Angl. direct reaction. S'applique
à une réaction chimique
réversible : la réaction directe est
la réaction écrite dans le sens
gauche-droite.
|
|
RÉACTION
ÉLÉMENTAIRE
|
Angl. elementary reaction. Au sens strict,
réaction chimique au cours de laquelle une
seule liaison chimique est rompue et une seule est
formée.
|
|
RÉACTION
EN CHAINE
|
Réaction complexe à
séquence fermée se
caractérisant par la
régénération d'espèces
intermédiaires à très courte
durée de vie appelées porteurs de
chaîne.
|
|
RÉACTION
EN CHAINES LINÉAIRES
|
Réaction en chaînes dont le
développement linéaire résulte
d'une succession d'étapes au cours
desquelles un porteur de chaîne réagit
pour en donner un autre.
|
|
REACTION
EN CHAINES RAMIFIÉES
|
Réaction en chaînes dont le
développement linéaire résulte
d'une succession d'étapes au cours
desquelles un porteur de chaîne réagit
pour en donner plus d’un autre.
|
|
RÉACTION
GLOBALE
|
Angl. overall reaction. Réaction
qui représente la somme de plusieurs
étapes élémentaires conduisant
symboliquement des produits aux réactifs
|
|
RÉACTION
INVERSE
|
Angl. reverse reaction. S'applique
à une réaction réversible : la
réaction inverse est la réaction
écrite dans le sens droite-gauche.
|
|
RÉACTION
ION-MOLÉCULE
|
Angl. ion-molecule reaction.
Réaction généralement
très rapide entre un ion et une
molécule.
|
|
RÉACTION
MONOMOLÉCULAIRE
|
Angl. unimolecular reaction.
Réaction élémentaire ne
mettant en jeu qu'une seule espèce
initiale.
|
|
RÉACTIONS
COMPÉTITIVES
|
Voir Réactions
parallèles.
|
|
RÉACTIONS
PARALLÈLES
|
Ensemble de réactions
qui se produisent simultanément pour
réaliser la transformation des
réactifs en produits.
|
|
RÉACTIONS
SIMULTANÉES
|
Voir Réactions
parallèles.
|
|
RÉACTION
THERMOLÉCULAIRE
|
Réaction en apparence
trimoléculaire, où la collision
d’une troisième molécule avec un
complexe résultant d’une
première collision bimoléculaire
vient le modifier de manière
irréversible en lui soutirant de
l’énergie interne.
|
|
RÉACTION
TRIMOLÉCULAIRE
|
Angl. trimolecular reaction.
Réaction élémentaire mettant
en jeu trois espèces initiales dans une
même collision réactionnelle. En fait,
c’est un cas très rare ! Voir
Réaction thermoléculaire.
|
|
RÉACTION
UNIMOLÉCULAIRE
|
Voir Réaction
monomoléculaire.
|
|
RÈGLE
DE LA MAIN DROITE
|
Un moyen mnémotechnique pour se souvenir
de l'orientation d'une force engendrée par
un champ électrique par un conducteur
parcouru par un courant électrique. Si le
pouce indique la direction du courant, l'index la
direction du champ électrique, l'orientation
de la force est donnée par celle du
majeur.
|
|
RENDEMENT
QUANTIQUE
|
Angl. quantum yield. Nombre de
molécules produites ou qui disparaissent
d’un milieu réactionnel par photon
absorbé par ce milieu.
|
|
RUPTURE DE
CHAÎNE
|
Généralement, dans un
mécanisme en chaîne, réaction
faisant disparaître les porteurs de
chaîne.
|
|
RYDBERG
|
Constante de. Utilisée en spectroscopie
Co de l'atome d'hydrogène, valant
RH = 1,097 373 127 × 107 m–1.
Formule de. Expression permettant de
systématiser quantitativement les raies
d'émission observées à partir
de l'atome d'hydrogène.
|
[ début
]
S
|
SCHRÖDINGER,
équation de
|
Équation permettant de calculer la
fonction d'onde d'un système de particules
atomiques, d'introduire rationnellement les nombres
quantiques et d'en calculer les niveaux
d'énergie.
|
|
SECOND ORDRE
|
Angl. second order. Une réaction
du second ordre est une réaction simple du
type A + A ou A + B admettant
un ordre global égal à 2. Sa vitesse
est de la forme
V = k [A]2
ou V = k [A]
[B].
|
|
SECONDE, s
|
Unité de temps de base du système
SI. C’est la durée de
9 192 631 770 périodes de la
radiation correspondant à la transition
entre les deux niveaux hyperfins de
l’état fondamental de l’atome de
césium 133.
|
|
SECTION
EFFICACE
|
Angl. cross section. Section du tube dans
lequel une particule A doit se trouver pour
interagir avec une particule B qui circule sur
l'axe du tube.
|
|
SIEMENS, S
|
Unité de conductance électrique du
système SI. C’est la conductance
d’un conducteur dont la résistance est
de 1 W .
|
|
SIEVERT, Sv
|
Unité SI de de dose biologique efficace
de rayonnement ionisant. C’est la dose
engendrée par un rayonnement ionisant dont
l’effet biologique est égal à
celui du rayonnement X ou γ de
200 à 250 keV.
|
|
SITE ACTIF
|
Groupe d'atomes, à la surface d'un solide
(réactif lui-même ou simplement paroi
d'un réacteur), responsable d'une
activité catalytique.
|
|
SPECTROMÉTRIE
DE MASSE
|
Angl. mass spectrometry. Technique d'analyse qui
permet l'identification et le dosage
d'espèces chimiques par formation d'ions qui
sont séparés en fonction de leur
masse.
|
|
SPIN
|
Nombre quantique associé au moment
magnétique de l’électron.
|
|
SPRAY
|
Mot anglais que l’on peut traduire par
brouillard.
|
|
STARK, effet
|
Effet d'un champ électrique sur les
niveaux rotationnels d'une molécule.
Chacun des niveaux J se dédouble en
2J + 1 sous-niveaux.
|
|
STEPHAN-BOLTZMANN,
loi de
|
Loi établissant l'énergie totale
rayonnée par le corps noir.
|
|
STERN et GERLACH,
expérience de
|
Expérience qui montre la présence
d'un moment angulaire intrinsèque.
|
|
STÉRADIAN, sr
|
Unité supplémentaire du
système SI. C’est l’angle solide
qui, ayant son sommet au centre d’une
sphère, découpe, sur la surface de
cette sphère, une aire égale à
celle d’un carré ayant pour
côté le rayon de la sphère.
|
|
STŒCHIOMÉTRIE
|
du grec stoicheion :
élément, et metron : mesure.
Étude du rapport des quantités selon
lesquelles les éléments se combinent
entre eux lors des réactions chimiques.
|
|
STOKES, St
|
Unité de mesure de viscosité
cinématique dans le système
d’unités C.G.S. Le stokes vaut 10–4
m2/s.
|
|
STRATOSPHÈRE
|
Région de l'espace située
approximativement entre 20 et 50 km d'altitude
où la température augmente avec
l'altitude. C'est aussi dans cette région
que l'on trouve les phénomènes
reliés à la couche d'ozone.
|
|
SUIE
|
Angl. soot. Les suies sont des particules
de carbone chargées de goudron de faible
diamètre (environ 1 nm) se
présentant sous la forme d'agrégats
de sphères élémentaires ayant
un diamètre de l'ordre de 10 à
50 nm.
|
|
SUPRACONDUCTIVITÉ
|
Angl. supeconductivity.
Phénomène observé à
basse température dans lequel un conducteur
n'offre plus de résistance au passage d'un
courant électrique.
|
|
SYSTÈME
C.G.S.
|
Système de mesures basé sur le
centimètre (longueur), le gramme (masse) et
la seconde (temps).
|
|
SYSTÈME
INTERNATIONAL D’UNITÉS (SI)
|
Système de mesures basé sur le
mètre (longueur), le kilogramme (masse), la
seconde (temps), l’ampère (courant), le
degré kelvin (température), et le
candéla (intensité lumineuse).
|
|
SYSTÈME
M.K.S.A.
|
Système de mesures basé sur
mètre, le kilogramme, la seconde et
l'ampère, apparenté au système
international d’unités (SI).
|
|
SYSTÈME SI
|
Voir Système
international d’unités.
|
[ début
]
T
|
TEMPS DE
DEMI-RÉACTION
|
Dans une réaction du type A →
produit, temps nécessaire à la
disparition de la moitié des
réactifs. Synonyme en physique
nucléaire :
période T.
|
|
TEMPÉRATURE
DE TRANSITION
|
Température à laquelle une
matière subit un changement important dans
ses propriétés comme les changements
de phase, la disparition des ses
propriétés de
suprconductivité, …
|
|
TÉRA, T
|
Multiple valant 1012 ou mille
milliards.
|
|
TERMINAISON
DE CHAÎNE
|
Voir Rupture de
chaîne.
|
|
TESLA, T
|
C’est l’induction magnétique
uniforme qui, répartie normalement sur une
surface plane de 1 m2, produit
à travers cette surface un flux
magnétique total de 1 Wb.
|
|
THERMODYNAMIQUE,
lois de
|
1ère loi : La variation
d'énergie interne d'un système est la
somme des échanges de la chaleur transmise
ou reçue et du travail effectué sur
ou à l'extérieur du
système.
2ème loi : L'entropie d'un
système fermé opérant
certaines transformations tend à être
maximum.
3ème loi : L'entropie d'un
système à 0 K est nulle.
|
|
THERMOSPHÈRE
|
Région de l'espace située vers
300 km d'altitude (± 100 km)
où la température augmente avec
l'altitude. C'est aussi dans cette région
que l'on trouve les aurores boréales.
|
|
TONNE, t
|
Unité de mesure de masse
tolérée avec le système SI et
valant 1000 kg. Ne pas confondre avec la tonne
anglaise ou américaine.
|
|
TRIMOLÉCULAIRE
|
Voir Réaction
trimoléculaire.
|
|
TROISIÈME
CORPS
|
Angl. third body. Espèce inerte
intervenant à basse pression dans une
réaction thermoléculaire pour
évacuer l'excès d'énergie
libérée lors de la recombinaison de
deux espèces réactives.
|
|
TROPOSPHÈRE
|
Région de l'espace située en
dessous de 20 km d'altitude où la
température diminue avec l'altitude et
où l'on retrouve les
phénomènes
météorolgiques courants.
|
|
TUBE À CHOC
|
Angl. shock tube. Un tube à choc
est un tube dans lequel est produite une onde de
choc plane, susceptible d'élever brutalement
la température et la pression d'un gaz.
|
|
TYNDALL, effet
|
Dispersion de la lumière visible à
travers une solution contenant des particules en
suspension.
|
[ début
]
U
|
ULTRAVIOLET (UV)
|
Région du spectre
électromagnétique
caractérisée par une longueur d'onde
de 200 à 400 nm et correspondant aux
transitions électroniques des atomes et des
molécules.
|
[ début
]
V
|
VAN DER WAALS, loi
de
|
Loi applicable aux gaz réels traduisant
l'existence de forces intermoléculaires et
mesurant l'écart à
l'idéalité
|
|
VAN'T HOFF, loi
de
|
Loi qui indique que la vitesse d'une
réaction chimique est égale au
produit d'une constante k et des
concentrations des différents
réactifs, chacune étant
affectée d'un exposant a, b,
... appelé ordre partiel de la
réaction par rapport au réactif
considéré :
V = k [A]a
[B]b.
|
|
VITESSE DE LA
LUMIÈRE
|
c = 2,997 924 58 × 108 m/s.
|
|
VOLT, V
|
Unité de potentiel électrique du
Système SI. C’est la différence
de potentiel électrique qui existe entre
deux points d’un fil conducteur parcouru par
un courant constant de 1 A lorsque la
puissance dissipée entre ces deux points est
égale à 1 W.
|
|
VOLUME
STANDARD DU GAZ IDÉAL
|
V = 22,413 83 × 10–3 m3/mol
ou l (litres). Synonyme : Volume T.P.N.
|
[ début
]
W
|
WATT, W
|
Unité de puissance du système
SI.
|
|
WEBER, Wb
|
Unité de flux d’induction
magnétique du système SI. C’est
le flux magnétique qui, traversant un
circuit d’une spire, y produit une force
électromotrice de 1 V, si on
l’amène à zéro en
1 s par décroissance uniforme.
|
|
WEISS
|
Voir Curie-Weiss (loi
de).
|
|
WIEN, loi de
|
Loi permettant de calculer le maximum
d'émission du corps noir.
|
[ début
]
X
|
RAYONS X
|
Région du spectre
électromagnétique
caractérisée par une longueur d'onde
de l'ordre de 0,1 nm et très utile en
cristallographie par exemple.
|
[ début
]
Y
|
YOUNG, expérience
de
|
Expérience de diffraction de la
lumière à travers deux fentes
parallèles montrant le caractère
ondulatoire de la lumière.
|
[ début
]
Z
|
ZEEMAN, effet
|
Effet d'un champ magnétique sur les raies
d'émission atomique se traduisant par un
dédoublement de celles-ci et leur
élargissement de manière
proportionnelle à la valeur du champ
magnétique.
|
|