MODULE 3 Vibration-rotation
des molécules diatomiques
Problèmes
-
Le spectre de rotation-vibration de l'oxyde de carbone comporte dans le proche infrarouge une bande intense dans la région de 2100-2200 cm–1. Avec un appareil de basse résolution on obtient la série de raies suivantes : 2124, 2128, 2132, 2136, 2140, 2148, 2152, 2156, 2160 cm–1.
- Déterminez le moment d'inertie, la
distance internucléaire et la fréquence
de vibration de la molécule CO.
- Déterminez la valeur de la constante de distorsion centrifuge de la même molécule.
- Déterminez le moment d'inertie, la
distance internucléaire et la fréquence
de vibration de la molécule CO.
-
La fréquence fondamentale de l'élongation O-H dans le méthanol est située à 3300 cm–1. Prédisez la position de la bande correspondante pour l'espèce isotopique CH3OD.
Note : Il n'y a pas de corrigés pour ce problème, ainsi que pour les problèmes 3 à 5.
- Le spectre infrarouge de H35Cl sous haute
résolution montre des raies d'absorption dont les
fréquences sont indiquées dans le tableau
qui suit. En utilisant un logiciel (ordinateur,
micro-ordinateur ou calculatrice appropriée),
calculez au moyen d'une régression linéaire
ou d'un moindre carré les coefficients du
polynôme suivant :
E = b + am + cm2 + dm3,
où E est l'énergie de la raie et
m un nombre entier.
Établissez au préalable la valeur de m pour chaque raie (colonne 3 du tableau suivant). Déduisez-en :
- l'énergie de la raie manquante;
- la valeur de ωe – 2 ωexe;
- les constantes B (υ = 0) et B′ (υ = 1);
- la constante de distorsion centrifuge D.
Tracez les courbes E (cm–1) = f (J) et E (cm–1) = f (m) sur le même graphe.
Spectre de rotation-vibration de H35Cl.
J
Énergie (cm–1)
m
ΔE (cm–1)
Δ(ΔE) (cm–1)
10
3072,8558
13,5338
9
3059,3220
-0,7244
14,2582
8
3045,0638
-0,7132
14,9714
7
3030,0924
-0,7036
15,6750
6
3014,4174
-0,6971
16,3721
5
2998,0453
-0,6598
17,0319
4
2981,0134
-0,6912
17,7231
3
2963,2903
-0,6461
18,3692
2
2944,9211
-0,6493
19,0185
1
2925,9026
-0,6300
19,6485
0
2906,2541
--
-
1
2865,1047
21,4745
2
2843,6302
-0,5816
22,0561
3
2821,5741
-0,5694
22,6255
4
2798,9486
-0,5565
23,1880
5
2775,7666
-0,5445
23,7265
6
2752,0401
-0,5288
24,2553
7
2727,7848
-0,5170
24,7723
8
2703,0125
-0,5041
25,2764
9
2677,7361
Données aimablement transmises par le prof. R. Colin, chimie-physique moléculaire Université Libre de Bruxelles, Bruxelles.
- Répétez le même problème
pour HBr, à partir de la liste suivante des
énergies des raies (en cm–1).
2 371,71
2 471,13
2 575,52
2 650,08
2 392,50
2 489,66
2 591,33
2 663,63
2 412,83
2 507,73
2 606,70
2 676,74
2 432,72
2 525,36
2 621,61
2 689,39
2 452,15
2 542,53
2 636,07
2 701,59
- Répétez le même problème
pour H37Cl.
2 675,9584
2 796,9750
2 923,7377
3 012,1328
2 701,1927
2 819,5661
2 942,7279
3 027,7879
2 725,9250
2 841,5877
2 961,0732
3 042,7419
2 750,1418
2 863,0289
2 978,7650
3 056,9840
2 773,8293
2 904,1162
2 995,7878
3 070,5036
- Le spectre infrarouge de DCl sous haute
résolution montre des raies d'absorption dont les
fréquences sont indiquées dans le tableau
ci-dessous. En vous servant des intensités
mesurées des raies, départagez les raies
appartenant à D35Cl et celles
appartenant à D37Cl. En vous inspirant
du problème 3 relatif à
H35Cl, calculez au moyen d'une
régression linéaire ou d'un moindre
carré, et cela pour chacune des deux
molécules isotopiques, les coefficients du
polynôme suivant :
E = b + am + cm2 + dm3,
où E est l'énergie de la raie et
m un nombre entier.
Établissez au préalable les valeurs de J et m pour chaque raie. Déduisez-en, pour D35Cl et D37Cl :
- l'énergie de la raie manquante;
- la valeur de ωe – 2
ωexe;
- les constantes B (υ = 0) et
B′ (υ = 1), ainsi que
les longueurs de liaison correspondantes;
- la constante de distorsion centrifuge D.
Tracez les courbes E (cm–1) = f (J) et E (cm–1) = f (m) sur le même graphe. Corrigé
Spectre de rotation-vibration de DCl : raies observées (υ = 0 → υ = 1).
nº
Énergie
(cm–1)Absorbance
nº
Énergie
(cm–1)Absorbance
1
2230,8479
0,043
31
2080,2753
1,096
2
2224,0387
0,089
32
2077,3076
0,384
3
2216,9606
0,156
33
2069,2694
1,761
4
2213,6323
0,049
34
2066,3342
0,686
5
2209,6132
0,280
35
2058,0468
2,133
6
2206,3007
0,086
36
2055,1451
0,866
7
2202,0025
0,455
37
2046,6072
2,224
8
2198,7071
0,156
38
2043,7399
0,888
9
2194,1272
0,696
39
2034,9590
2,186
10
2190,8502
0,243
40
2032,1271
0,875
11
2185,9952
0,997
41
2023,1001
1,998
12
2182,7377
0,346
42
2020,3044
0,764
13
2177,6036
1,360
43
2011,0405
1,761
14
2174,3672
0,487
44
2008,2814
0,654
15
2168,9620
1,709
45
1998,7764
1,436
16
2165,7472
0,638
46
1996,0555
0,521
17
2160,0666
2,006
47
1986,3186
1,105
18
2156,8750
0,783
48
1983,6365
0,381
19
2150,9268
2,201
49
1973,6637
0,785
20
2147,7596
0,901
50
1971,0211
0,263
21
2141,5397
2,336
51
1960,8216
0,533
22
2138,3978
0,984
52
1958,2191
0,173
23
2131,9144
2,342
53
1947,7905
0,344
24
2128,7986
1,000
54
1945,2297
0,112
25
2122,0484
2,221
55
1934,5784
0,198
26
2118,9605
0,918
56
1932,0590
0,067
27
2111,9499
1,845
57
1921,1853
0,111
28
2108,8904
0,713
58
1918,7094
0,036
29
2101,6186
1,138
59
1907,6167
0,058
30
2098,5888
0,392
60
1893,8780
0,031
Données aimablement transmises par le prof. R. Colin, chimie-physique moléculaire Université Libre de Bruxelles, Bruxelles.
- l'énergie de la raie manquante;
- Mêmes questions pour la transition (υ
= 0 → υ = 2). Corrigé
Spectre de rotation-vibration de DCl : raies observées (υ = 0 → υ = 2).
nº
Énergie
(cm–1)Absorbance
nº
Énergie
(cm–1)Absorbance
1
4226,6804
0,056
23
4132,8950
0,047
2
4221,9699
0,064
24
4117,6476
0,136
3
4216,7621
0,109
25
4111,8404
0,049
4
4211,0878
0,162
26
4106,4180
0,245
5
4210,7603
0,052
27
4100,6380
0,075
6
4204,9374
0,250
28
4094,7565
0,295
7
4198,8805
0,091
29
4089,0130
0,104
8
4198,2980
0,270
30
4082,6384
0,306
9
4192,2631
0,093
31
4076,9159
0,095
10
4191,1839
0,331
32
4070,1033
0,287
11
4185,1716
0,103
33
4064,4441
0,089
12
4183,6147
0,357
34
4057,1180
0,249
13
4177,6210
0,1222
35
4051,4871
0,080
14
4175,5631
0,395
36
4043,7218
0,203
15
4169,5941
0,123
37
4038,1402
0,072
16
4167,0576
0,399
38
4029,8939
0,170
17
4161,1125
0,128
39
4024,3623
0,061
18
4158,0845
0,352
40
4015,6564
0,121
19
4152,1627
0,122
41
4010,1606
0,041
20
4148,6556
0,279
42
4000,9944
0,087
21
4142,7492
0,092
43
3985,9164
0,061
22
4138,7699
0,145
44
3970,4534
0,042
Données aimablement transmises par M. Carleer du laboratoire du prof. R. Colin, chimie-physique moléculaire, Université Libre de Bruxelles, Bruxelles.
- Pour la molécule DCl, la documentation donne
les informations numériques suivantes (en cm–1)
:
Be = 5,448 794, αe = 0,113 291
En utilisant la relation qui existe entre la constante de rotation et le niveau de vibration, comparez les valeurs obtenues pour les valeurs de B (υ = 0), B (υ = 1) et B (υ = 2) des deux problèmes précédents. Corrigé
- Vérifiez graphiquement que B varie
comme l'inverse de la distance internucléaire dans
le cas de divers états électroniques de
l'oxyde de carbone. Déterminez de la même
manière, en traçant les graphes
appropriés, la dépendance de ωe
avec la distance internucléaire.
Que pouvez-vous dire de la relation, s'il en existe une, entre ωe et la distance internucléaire? CorrigéÉtat électronique
re
(pm)B
(cm–1)ωe
(cm–1)X 1Σ+112,831,93132169,8a 3Πr120,571,69121743,4a′ 3Σ+135,231,34461228,6d 3Δi136,961,31091171,9e 3Σ–138,41,28361117,7A 1Π123,531,61151518,2I 1Σ–139,111,27051092,2D 1Δ139,91,2571094,0b 3Σ+111,31,9862199,3Valeurs tirées de http://webbook.nist.gov/chemistry/name-ser.html
- Pour la molécule C=S, on observe les valeurs suivantes (en cm–1) : ωe = 1285,08, Be = 0,8200 et De = 1,43 × 10–6. Comparez la valeur de ωe obtenue à l’aide de l’approximation 3.6 avec la valeur expérimentale. Corrigé
Problèmes avec VR Molécules
- Placez VR Molécules à la page 6.
En faisant varier si nécessaire les nombres
quantiques, déterminez les valeurs des constantes
ωe, ωexe,
Be et αe
pour la molécule HCl. Corrigé
- Placez VR Molécules à la page 7.
Vérifiez les relations 3.7, 3.8 et 3.9 pour ces
deux variantes de la molécule d'hydrogène.
Corrigé
- Placez VR Molécules à la page 8. En cliquant sur le nom de la molécule contrôlée, en haut à gauche, sélectionnez une des molécules suivantes : O2, Cl2, HF, CO, N2. Pour la molécule que vous avez choisie, déterminez le plus grand nombre de constantes moléculaires possible. N'oubliez pas d'activer si nécessaire les corrections d'énergie (dans la fenêtre en bas à gauche portant ce nom, qui apparaît ou disparaît quand on clique sur le bouton ΔE situé sous le nom de la molécule.) Corrigé
Corrigés
-
- On note que les raies sont
également espacées d’une
énergie de 4 cm–1.
2B = 4 cm–1 et B = 2 cm–1
On reconnaît sans difficulté l’absence d’une raie à 2144 cm–1. Cette raie représente la transition de vibration pure. Cette transition est inexistante à cause de la règle de sélection ΔJ = ±1. Les raies situées à des énergies supérieures font partie des raies riches, R (ΔJ = +1) et celles à plus basses énergies sont appelées les raies pauvres, P (ΔJ = –1).
Le moment d’inertie de la molécule est obtenu à l’aide de la relation :
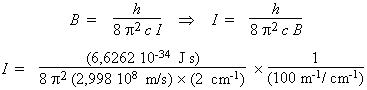
I = 14,00 × 10–47 kg × m2
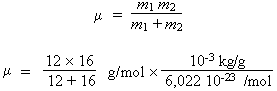
μ = 1,1387 10–26 kg
Le facteur 10–3 est introduit pour tenir compte du fait que les masses atomiques sont exprimées en kg/mol et que le rotateur étant bien la molécule, la masse de la molécule est égale à la masse molaire divisée par le nombre d’Avogadro.
En remplaçant chaque valeur littérale par sa valeur numérique, on obtient :
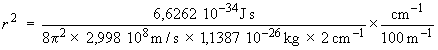
r2 = 1,229 × 10–20 m2
⇒ r = 1,109 × 10–10 m = 110,9 pm
Notons que ce résultat peut être obtenu plus simplement grâce à la relation r2 = I / μ.
- Les données numériques suggèrent que l'intervalle entre les raies est constant, ce qui laisse entrevoir que la constante de distorsion centrifuge est nulle, ou du moins très faible. Pour obtenir sa valeur, il aurait fallu utiliser un appareil de mesure à grande résolution, de façon à pouvoir mesurer les raies avec une précision de un ou deux ordres de grandeur supérieure. Par ailleurs, l’observation et la mesure de plusieurs autres raies auraient sans doute facilité cette mesure.
- On note que les raies sont
également espacées d’une
énergie de 4 cm–1.
-
Calcul de l'énergie de la raie manquante.
Une méthode simple, utile mais non rigoureuse, consiste à réaliser que la valeur de la raie manquante peut se déduire approximativement de la moyenne arithmétique de la valeur des deux raies qui encadrent cette raie.
Énergie (raie manquante) = [ E(J = 0 → J = 1) + E(J = 1 → J = 0) ] / 2
En portant sur un graphe l'intensité de la raie en fonction de son énergie exprimée en cm–1 (figure ci-dessous), on observe que l'on a deux groupes de raies.
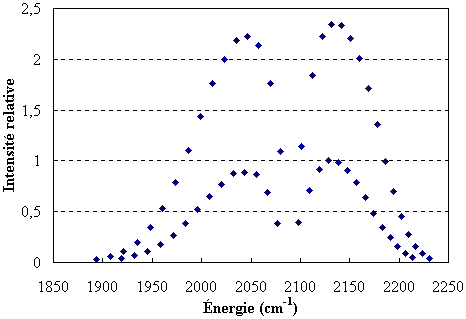
Compte tenu des proportions isotopiques, la série de raies plus intenses correspond au D35Cl et l'autre au D37Cl. On peut donc constituer un tableau (voir tableau suivant) dans lequel on a regroupé dans les deux premières colonnes ce qui a trait au D35Cl et dans les 5e et 6e colonnes ce qui correspond au D37Cl. Dans le premier cas, la raie manquante aurait une énergie telle que :
Énergie (raie manquante) = [ 2 101,62 + 2 080,27 ] / 2 = 2 090,94 cm–1
De la même manière, pour D37Cl :
Énergie (raie manquante) = [ 2 101,62 + 2 080,27 ] /2 = 2 090,94 cm–1
Énergie (raie manquante) = [ 2 098,59 + 2 077,31 ] /2 = 2 087,95 cm–1
Les vraies valeurs, plus rigoureuses, vont apparaître lors de la résolution de la cubique E = ¦(m), après avoir changé la variable J en m. Il est donc nécessaire d'établir pour chaque raie, sa valeur de J. Les deux séries de raies se présentent sous la forme de deux lobes, l'un plus riche en énergie que l'autre. On identifiera ainsi les raies riches et les raies pauvres dans chacun des cas. La raie la moins énergétique de la bande riche porte la valeur de J = 0 et la raie la plus énergétique de la bande pauvre porte la valeur J = 1. On peut donc remplir les colonnes 3 et 7 du tableau.
nº
Énergie
(cm–1)JD35Cl
m
nº
Énergie
(cm–1)JD37Cl
m
1
2230,8479
+ 15
+ 16
2
2224,0387
+ 14
+ 15
3
2216,9606
+ 13
+ 14
4
2213,6323
+ 13
+ 14
5
2209,6132
+ 12
+ 13
6
2206,3007
+ 12
+ 13
7
2202,0025
+ 11
+ 12
8
2198,7071
+ 11
+ 12
9
2194,1272
+ 10
+ 11
10
2190,8502
+ 10
+ 11
11
2185,9952
+ 9
+ 10
12
2182,7377
+ 9
+ 10
13
2177,6036
+ 8
+ 9
14
2174,3672
+ 8
+ 9
15
2168,9620
+ 7
+ 8
16
2165,7472
+ 7
+ 8
17
2160,0666
+ 6
+ 7
18
2156,8750
+ 6
+ 7
19
2150,9268
+ 5
+ 6
20
2147,7596
+ 5
+ 6
21
2141,5397
+ 4
+ 5
22
2138,3978
+ 4
+5
23
2131,9144
+ 3
+ 4
24
2128,7986
+ 3
+ 4
25
2122,0484
+ 2
+ 3
26
2118,9605
+ 2
+ 3
27
2111,9499
+ 1
+ 2
28
2108,8904
+ 1
+ 2
29
2101,6186
0
+ 1
30
2098,5888
0
+ 1
raie manquante
raie manquante
31
2080,2753
+ 1
- 1
32
2077,3076
+ 1
- 1
33
2069,2694
+ 2
- 2
34
2066,3342
+ 2
- 2
35
2058,0468
+ 3
- 3
36
2055,1451
+ 3
- 3
37
2046,6072
+ 4
- 4
38
2043,7399
+ 4
- 4
39
2034,9590
+ 5
- 5
40
2032,1271
+ 5
- 5
41
2023,1001
+ 6
- 6
42
2020,3044
+ 6
- 6
43
2011,0405
+ 7
- 7
44
2008,2814
+ 7
- 7
45
1998,7764
+ 8
- 8
46
1996,0555
+ 8
- 8
47
1986,3186
+ 9
- 9
48
1983,6365
+ 9
- 9
49
1973,6637
+ 10
- 10
50
1971,0211
+ 10
- 10
51
1960,8216
+ 11
- 11
52
1958,2191
+ 11
- 11
53
1947,7905
+ 12
- 12
54
1945,2297
+ 12
- 12
55
1934,5784
+ 13
- 13
56
1932,0590
+ 13
- 13
57
1921,1853
+ 14
- 14
58
1918,7094
+ 14
- 14
59
1907,6167
+ 15
- 15
60
1893,8780
+ 16
- 16
On peut essayer de porter sur un graphe les valeurs des énergies de chacune des raies en fonction de J (figure 1). On voit que ces courbes ne permettent pas d'obtenir la valeur de l'énergie de la transition vibrationnelle pure en utilisant l'ensemble des données numériques.
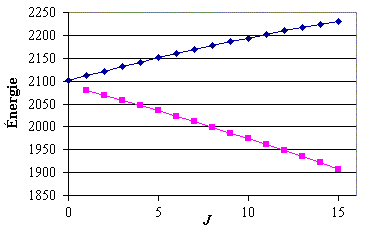
Figure 1. Variation de l'énergie des raies en fonction de J (cas D35Cl).Après avoir identifié les valeurs de J, il convient d'effectuer les changements de variables appropriés. Pour les raies riches, le changement de variables est tel que m = J + 1 et pour les raies pauvres, m = –J. On constitue ainsi les 4e et 8e colonnes du tableau précédent. Pour compléter les calculs, il ne reste plus qu'à effectuer une régression d'ordre 3 en m sur chacune des deux molécules.
ΔE = b + am + cm2 + dm3
Dans cette équation :
- l'ordonnée à l'origine b est l'énergie de la transition vibrationnelle pure, égale à ωe – 2 ωexe;
- a = B″ + B′, où B″ et B′ sont les constantes rotationnelles dans chacun des deux niveaux de vibration;
- c = B″ – B′;
- d = – 4 D, où D est la constante de distorsion centrifuge.
L'utilisation d'un chiffrier, ou encore d'un logiciel graphique ou statistique, établit les deux relations suivantes :
Figure 2 : y (D35Cl) = –0,0006 m3 – 0,1121 m2 + 10,6719m + 2091,0506
R 2 = 1,0000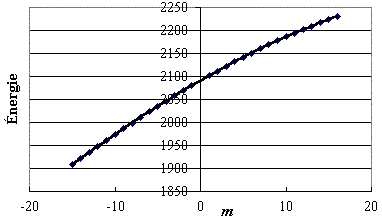
Figure 2. Énergie des raies en fonction de m (cas D35Cl).Figure 3 : y (D37Cl) = –0,0006 m3– 0,1117 m2 + 10,6409 m + 2088,0547
R 2 = 1,0000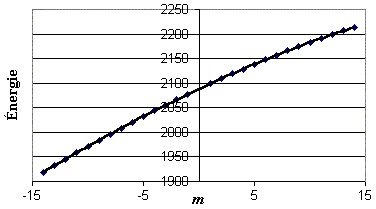
Figure 3. Énergie des raies en fonction de m (cas D37Cl).On obtient donc les valeurs suivantes :
Molécule
ωe – 2 ωexe
(cm–1)B′
(cm–1)B″
(cm–1)D
(cm–1)D35Cl
2091,0516
5,3918
5,2797
1,5 10–4
D37Cl
2088,4893
5,3763
5,2646
1,5 10–4
On notera que les valeurs de ωe sont significativement différentes des moyennes arithmétiques calculées en début de problème.
-
Réponses :
B′ (D35Cl, υ = 0) = 5,3922 cm–1; B″ (D35Cl, υ = 2) = 5,1684 cm–1.
-
La relation qui existe entre la constante de rotation et le niveau de vibration est :
Bυ = Be – αe (υ + 1/2) + ...
On peut dès lors compléter le tableau qui suit et noter la bonne coïncidence entre les résultats théoriques et ceux obtenus précédemment.
υ
B (cm–1)
théorique
problèmes 6 et 7
0
5,392 215
5,392 2
1
5,278 857
5,2797
2
5,165 566
5,168 4
-
Si I est le moment d'inertie, μ la masse réduite et r la longueur de la liaison, alors la constante de rotation B est donnée par :
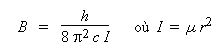
La constante de rotation d'une molécule diatomique varie comme l'inverse de la distance internucléaire au carré. Donc sur un graphe, si l'on porte la grandeur B en fonction de l'inverse de cette distance au carré on doit obtenir une droite. C'est ce que montre le graphe qui suit. Notons que le coefficient de corrélation R 2 est bien égal à l'unité.
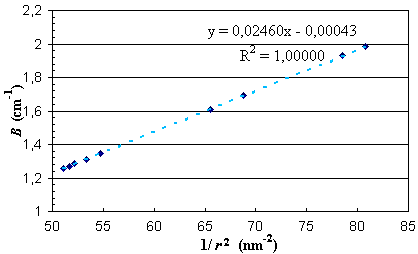
Figure 4. Variations de B en fonction de l'inverse du carré de la longueur de la liaison C=O.Par ailleurs, le module n'apporte pas de réponse quant à une éventuelle dépendance de ωe en fonction de la longueur de la liaison. Le tableau des données indiqué plus haut montre que ωe diminue avec l'allongement de la liaison. Cela est confirmé par le graphe qui suit. Cette figure ne précise évidemment pas le type de relation entre les deux grandeurs.
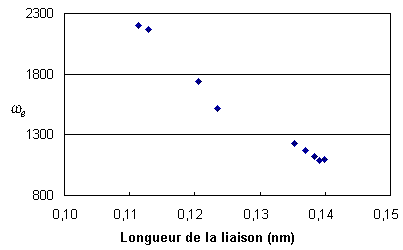
L'obtention d'une courbe de tendance peut parfois aider à préciser cette dépendance. Une régression linéaire et une régression polynomiale d'ordre 2 donnent les équations suivantes :
y = – 3854,1 x + 6 439,8 avec R 2 = 0,9762
y = – 8398,7 x2 – 25040 x + 19 693 avec R2 = 0,9945
Le coefficient de corrélation donne un avantage à la dépendance quadratique de ωe sur la longueur de la liaison. La différence, pour significative qu'elle soit, n'est pas suffisante pour confirmer cette dépendance.
-
Ce problème est simple à solutionner. Il s'agit seulement de traduire en chiffres la relation suivante :
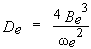
D'où :
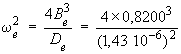
ωe2 = 1,542 × 106 (cm–1)2
et ωe = 1 240 cm–1
La valeur ainsi calculée est inférieure à la valeur observée qui est de 1 285,08 cm–1, soit un écart d’environ 3,5 %.
Corrigés des problèmes avec VR Molécules
-
Les constantes apparaissent dans l'expression du terme spectral, où la constante rotationnelle B inclut la correction due à l'interaction vibration-rotation :
E(υ, J) = G(υ) + F(J)
E(υ, J) = ωe (υ + 1/2) – ωexe (υ + 1/2)2 + [ Be – αe (υ + 1/2) ] J (J + 1)Pour un maximum de précision, on emploiera les plus grandes valeurs possibles des nombres quantiques.
Pour ωe, on utilise l'énergie du niveau υ = 5, avec J = 0 et l'anharmonicité désactivée. On trouve :
ωe = 16 450 / 5,5 = 2 990,9 cm–1
Pour ωexe, on évalue, toujours pour le niveau υ = 5, la différence d'énergie ΔE avec et sans l'anharmonicité, égale à ωexe (υ + 1/2)2. On trouve :
ωexe = ΔE (υ, J) / (υ + 1/2)2 = (16 450 – 14 850) / 5,52 = 53 cm–1.
Be est déterminé à partir de l'énergie pour J = 30 :
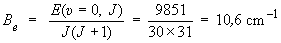
Finalement, αe est déterminé à partir de la différence d'énergie ΔE, pour υ = 5 et J = 30, avec et sans interaction vibration-rotation, égale à :
αe (υ + 1/2) J (J + 1)
On trouve :
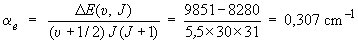
-
Les masses réduites de H2 et HD sont respectivement égales à 1/2 et 2/3. Le rapport μ / μi est donc égal à 3/4.
Le rapport Be,i / Be est égal à 42 500 / 56 540 = 0,752, ce qui est conforme à l'équation 3.7.
Le rapport ωe,i / ωe est égal à 20 970 / 24 170 = 0,868, une valeur proche de la racine carrée de μ / μi (0,866), prédite par l'équation 3.8.
Le rapport ωe,ixe,i / ωexe est égal à (20 970 – 18 190) / (24 170 – 20 500) = 0,757, ce qui est conforme à l'équation 3.9.
-
Employez la même méthode qu'au problème VR Molécules nº 1, et vérifiez vos réponses dans le WebBook du site du NIST : http://webbook.nist.gov/chemistry/name-ser.html. Note : Les constantes correspondant à la molécule dans son état électronique fondamental sont à la dernière ligne des tableaux.